Sorry, this activity is currently hidden
Section outline
-
ТЕМА 1. ЩО ТАКЕ МАТЕРІАЛОЗНАВСТВО?

Мета: ознайомитися з основними поняттями матеріалознавства, мати уяву про методи та основні положення науки матеріалознавства.
-
ТЕМА 2. БУДОВА И ВЛАСТИВОСТІ МАТЕРІАЛІВ

Мета: визначити типи кристалічних решіток, закономірності формування структури і властивостей матеріалів, встановити залежність між структурою та властивостями, сформувати знання про властивості основних різновидів матеріалів.
-
ТЕМА 3. ДИВОВИЖНІ ВЛАСТИВОСТІ МЕТАЛІВ
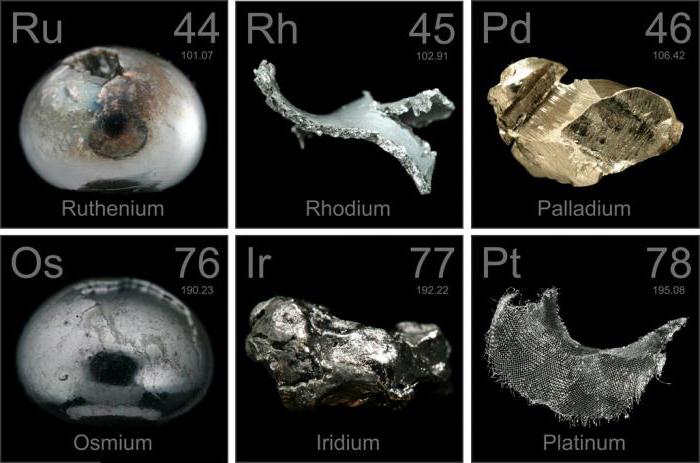
Мета: визначати властивості матеріалів, знайти практичне застосування даним властивостям в повсякденному житті.
-
ТЕМА 4. СТВОРЕННЯ МАТЕРІАЛОВ З ЗАДАННИМИ ВЛАСТИВОСТЯМИ

Мета:

